NGHIÊN CỨU TƯƠNG ĐƯƠNG SINH HỌC
Nghiên cứu và phát triển thuốc là 01 quá trình lâu dài và tốn kém. Để 01 thuốc được công nhận và lưu hành trên thị trường, quá trình này phải tốn ít nhất từ 12 đến 15 năm, với số tiền lên đến hàng vài chục triệu đô la. Chính vì vậy, sau khi nghiên cứu 01 thuốc thành công, nhà sản xuất có quyền bảo hộ độc quyền thuốc đó trong vòng 20 năm. Thuốc được ra đời đầu tiên gọi là thuốc phát minh (Innovator Pharmaceutical Product), và lưu hành trên thị trường dưới dạng biệt dược gốc (Trade Name)
Thuốc biệt dược gốc thường có giá thành cao, trong vòng 20 năm khai thác độc quyền, không một nhà sản xuất thuốc nào trên thế giới có thể can dự vào quy trình sản xuất thuốc. Vì lẽ đó mà không phải mọi người dân trên thế giới đều có thể tiếp cận được với thuốc, nhất là người dân ở các nước nghèo, nước đang phát triển.
Sau thời gian bảo hộ độc quyền, các công ty Dược ở các nước có quyền khai thác và sản xuất thuốc theo quy trình đã được công bố. Lúc này, tên thuốc ban đầu sẽ trở thành tên chung quốc tế (thuốc generic).
Với sự bùng nổ của ngành công nghiệp Dược, với hàng trăm, thậm chí hàng nghìn công ty Dược khác nhau ở khắp nơi trên thế giới thì với một biệt dược gốc ban đầu, sau thời hạn bảo hộ độc quyền có thể sẽ có hàng trăm, hàng nghìn biệt dược mới với cùng một tên generic.
Làm sao để đảm bảo các thuốc generic đó có cùng chất lượng với thuốc phát minh?
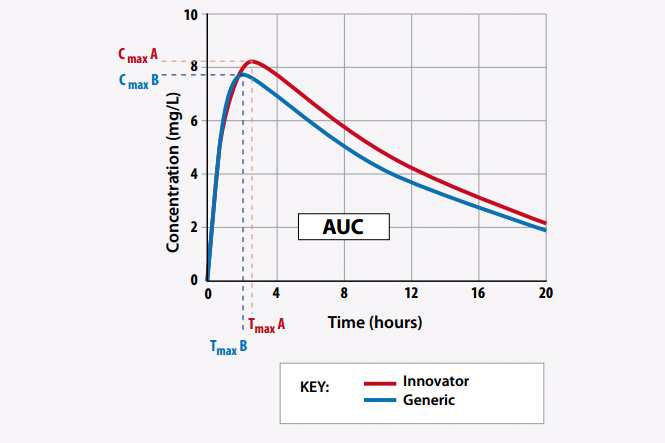
TƯƠNG ĐƯƠNG SINH HỌC CHÍNH LÀ CHÌA KHÓA ĐỂ TRẢ LỜI CÂU HỎI NÀY
Tương đương sinh học là sự tương tự nhau về sinh khả dụng giữa hai thuốc khi được so sánh trong cùng một điều kiện thử nghiệm (Luật Dược năm 2016). Nói cách khác, hai thuốc được coi là tương đương sinh học nếu chúng là những thuốc tương đương bào chế hay là thế phẩm bào chế, và sinh khả dụng của chúng sau khi dùng cùng một mức liều trong cùng điều kiện thử nghiệm là tương tự nhau dẫn đến hiệu quả điều trị của chúng về cơ bản sẽ được coi là tương đương nhau (Thông tư 08/2010/TT-BYT).
Nghiên cứu tương đương sinh học được thực hiện theo một quy định nghiêm túc và ngặt nghèo. Quy định này đã được sự đồng thuận và thống nhất trong khối ASIAN, có tham chiếu với các quy định của cơ quan quản lý Dược phẩm châu u và cơ quan quản lý dược phẩm, thực phẩm Mỹ (FDA).
Trong nghiên cứu tương đương sinh học, có 02 pha quan trọng nhất là pha lâm sàng (là những nghiên cứu liên quan đến khía cạnh con người) và pha phân tích dịch sinh học (là pha liên quan đến quy trình kỹ thuật và độ chính xác của nghiên cứu). Cả 2 pha này đều phải thực hiện ở các trung tâm nghiên cứu đạt chuẩn (Chuẩn GCP: thực hành tốt thử nghiệm lâm sàng đối với pha nghiên cứu trên người; và chuẩn GLP: thực hành phòng thí nghiệm tốt đối với pha phân tích dịch sinh học).
KẾT QUẢ THỬ TƯƠNG ĐƯƠNG SINH HỌC CÓ Ý NGHĨA RẤT QUAN TRỌNG:
- Cung cấp bằng chứng về mức độ tương đương sinh học của thuốc thử so với thuốc đối chứng, gián tiếp cho biết khả năng thay thế lẫn nhau của thuốc thử so với thuốc chứng trong điều trị (tương đương điều trị)
- Là cơ sở để cấp phép lưu hành thuốc (đối với một số thuốc bắt buộc phải thử tương đương sinh học)
- Giúp doanh nghiệp phát triển sản phẩm, xây dựng thương hiệu, cạnh tranh lành mạnh.
- Xây dựng hàng rào kỹ thuật trong hội nhập kinh tế toàn cầu, khu vực.
- Góp phần đảm bảo công bằng và lợi ích cho người bệnh trong điều trị.